Thông tin chi tiết về phương trình
Điều kiện phản ứng khi cho tác dụng KClO3 + P
- Chất xúc tác: không có
- Nhiệt độ: > 250
- Áp suất: thường
- Điều kiện khác: không có
Quá trình phản ứng KClO3 + P
Quá trình: đang cập nhật...
Lưu ý: không có
Hiện tượng xảy ra sau phản ứng KClO3 + P
Hiện tượng: đang cập nhật...
Thông tin chi tiết các chất tham gia phản ứng
Thông tin về KClO3 (kali clorat)
- Nguyên tử khối: 122.5495
- Màu sắc: màu trắng
- Trạng thái: tinh thể, rắn
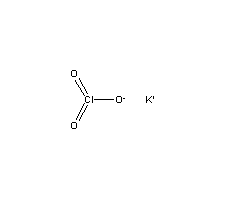
Được sử dụng trong nhiều ngành công nghiệp: thuốc pháo, ngòi nổ, thuốc đầu diêm... và nông nghiệp: thuốc giúp nhãn ra hoa......
Thông tin về P (photpho)
- Nguyên tử khối: 30.9737620 ± 0.0000020
- Màu sắc: Không màu, trắng sáp, đỏ tươi hơi vàng, đỏ, tím, đen
- Trạng thái: chất rắn

Axít phốtphoric đậm đặc, có thể chứa tới 70% - 75% P2O5 là rất quan trọng đối với ngành nông nghiệp do nó được dùng để sản xuất phân bón. Nhu cầu toàn cầu về phân bón đã dẫn tới sự tăng trưởng đáng kể trong sản xuất phốtphat (PO43-) trong nửa sau của thế kỷ XX. Các sử dụng khác còn có: Các phốtph...
Thông tin chi tiết các chất sản phẩm sau phản ứng
Thông tin về KCl (kali clorua)
- Nguyên tử khối: 74.5513
- Màu sắc: tinh thể màu trắng
- Trạng thái: Chất rắn

Ở dạng chất rắn kali clorua tan trong nước và dung dịch của nó có vị giống muối ăn. KCl được sử dụng làm phân bón,[6] trong y học, ứng dụng khoa học, bảo quản thực phẩm, và được dùng để tạo ra ngừng tim với tư cách là thuốc thứ ba trong hỗn hợp dùng để tử hình thông qua tiêm thuốc độc. Nó xuất hiện...
Thông tin về P4O10 (Phospho pentoxit)
- Nguyên tử khối: 283.8890
- Màu sắc: bột trắng dễ chảy rữa mùi hăng
- Trạng thái: chất rắn
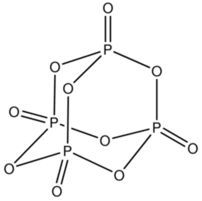
Phốtpho pentôxít là một chất khử nước mạnh, như chỉ ra bởi bản chất tỏa nhiệt trong sự thủy phân nó: P4O10 + 6 H2O → 4 H3PO4 (–177 kJ) Tuy nhiên, việc sử dụng nó để làm khô bị hạn chế do nó có xu hướng tạo ra một lớp che phủ bảo vệ dạng nhớt ngăn cản sự khử nước tiếp theo của vật liệu còn lại....