Thông tin chi tiết về phương trình
Điều kiện phản ứng khi cho tác dụng Zn + FeCl3
- Chất xúc tác: không có
- Nhiệt độ: thường
- Áp suất: thường
- Điều kiện khác: không có
Quá trình phản ứng Zn + FeCl3
Quá trình: cho Zn tác dụng với FeCl3
Lưu ý: không có
Hiện tượng xảy ra sau phản ứng Zn + FeCl3
Hiện tượng: FeCl2 màu lục nhạt
Thông tin chi tiết các chất tham gia phản ứng
Thông tin về Zn (kẽm)
- Nguyên tử khối: 65.3800
- Màu sắc: Ánh kim bạc xám
- Trạng thái: Chất rắn

Kẽm là kim loại được sử dụng phổ biến hàng thứ tư sau sắt, nhôm, đồng tính theo lượng sản xuất hàng năm. Các ứng dụng chính của kẽm (số liệu là ở Hoa Kỳ)[98] Mạ kẽm (55%) Hợp kim (21%) Đồng thau và đồng điếu (16%) Khác (8%) Chống ăn mòn và pin Kim loại kẽm chủ yếu được dùng làm chất chống ăn...
Thông tin về FeCl3 (Sắt triclorua)
- Nguyên tử khối: 162.2040
- Màu sắc: lục đậm dưới ánh sáng phản chiếu; đỏ tím dưới ánh sáng thường
- Trạng thái: Chất rắn
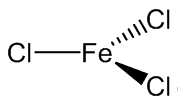
Sắt(III) clorua được dùng làm tác nhân khắc axit cho bản in khắc; chất cầm màu; chất xúc tác trong tổng hợp hữu cơ; chất làm sạch nước; dùng trong nhiếp ảnh, y học,.....
Thông tin chi tiết các chất sản phẩm sau phản ứng
Thông tin về Fe (sắt)
- Nguyên tử khối: 55.8450
- Màu sắc: Ánh kim xám nhẹ T
- Trạng thái: Chất rắn
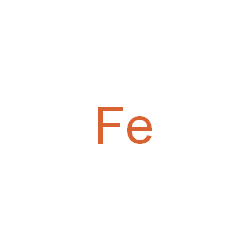
Sắt là kim loại được sử dụng nhiều nhất, chiếm khoảng 95% tổng khối lượng kim loại sản xuất trên toàn thế giới. Sự kết hợp của giá thành thấp và các đặc tính tốt về chịu lực, độ dẻo, độ cứng làm cho nó trở thành không thể thay thế được, đặc biệt trong các ứng dụng như sản xuất ô tô, thân tàu thủy lớ...
Thông tin về FeCl2 (sắt (II) clorua)
- Nguyên tử khối: 126.7510
- Màu sắc: xám
- Trạng thái: chất rắn
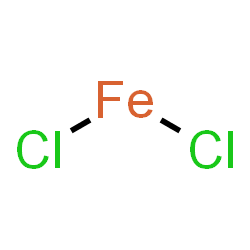
Sắt(II) clorua là một hợp chất hóa học có công thức là FeCl2. Nó là một chất rắn thuận từ có nhiệt độ nóng chảy cao, và thường thu được dưới dạng chất rắn màu trắng. Tinh thể dạng khan có màu trắng hoặc xám; dạng ngậm nước FeCl2.4H2O có màu vàng lục. Trong không khí, nó dễ bị chảy rữa và bị oxi hoá ...
Thông tin về ZnCl2 (Kẽm clorua)
- Nguyên tử khối: 136.2860
- Màu sắc: màu trắng
- Trạng thái: chất rắn
Kẽm clorua là tên của các hợp chất với công thức hóa học ZnCl2 và các dạng ngậm nước của nó. Kẽm clorua, với tối đa ngậm 9 phân tử nước, là chất rắn không màu hoặc màu trắng, hòa tan rất mạnh trong nước.[cần dẫn nguồn] ZnCl2 khá hút ẩm và thậm chí dễ chảy nước. Do đó, các mẫu vật của muối này nên đư...